Begränsad kunskap om nya läkemedel vid godkännandet
Publicerat 2017-05-11
Sedan ett antal år godkänns vissa nya läkemedel av läkemedelsmyndigheter både i Europa och USA med krav på uppföljande studier av effekt och säkerhet. Det betyder att det vid godkännandet finns begränsad information om läkemedlet.
Mellan 2006 och juni 2016 godkändes 30 nya läkemedel av den europeiska läkemedelsmyndigheten, EMA, med villkor om krav på uppföljande studier, till exempel långtidsstudier av effekt och säkerhet. De vanligaste terapiområdena var onkologi (17 av 30) och infektion (9 av 30).
Conditional approval, villkorat godkännande, kan vara aktuellt vid till exempel livshotande sjukdomar, läkemedel vid nödsituationer som svar på hot mot folkhälsan och för särläkemedel.
Bakom godkännandena låg sammanlagt 58 pivotala studier, varav 35 stycken var fas I- och fas II-studier och 21 stycken var fas III-studier. I endast två av studierna fanns en aktiv kontrollarm. I de flesta studierna var behandlingssvar det primära utfallet, i få eller inget fall rapporterades kliniskt relevanta effekter av behandlingen.
EMA krävde ytterligare resultat från sammanlagt 77 studier. Endast i nio av studierna var det primära utfallsmåttet överlevnad, samtliga inom onkologi. Livskvalitet fanns inte med som primärt utfallsmått. Tretton av 77 var säkerhetsstudier.
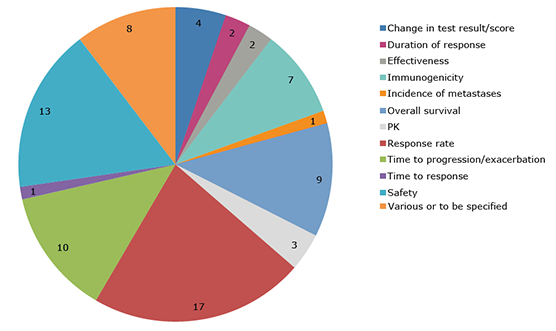
Kategorier för primära utfallsmått i de 77 studierna. Källa [1].
Förfarandet med villkorat godkännande har enligt EMA tidigarelagt godkännande av läkemedel med i genomsnitt fyra år. I en editorial i BMJ ifrågasätts om denna tidiga tillgång till ofullständigt studerade nya läkemedel kan vara etiskt försvarbar, då varken den behandlande läkaren eller patienten kan få information om den sanna risk/nytta-profilen av läkemedlet.
Hittills har 11 av de 30 nya läkemedlen blivit standardgodkända, 2 har dragits tillbaka av kommersiella skäl och 17 har fortfarande villkorat godkännande.
Läkemedel godkända av FDA
I USA tillämpas så kallad lifecycle evaluation, som innebär att godkända läkemedel fortsätter att studeras under hela läkemedlets livscykel. Av 188 nya läkemedel godkända av den amerikanske läkemedelsmyndigheten, FDA, mellan 2005 och 2012 var det 117 stycken som godkändes med endast en pivotal studie (n=71) som grund och/eller endast på bas av surrogatmarkörer, istället för kliniskt relevanta parametrar. Vanligast var onkologiska indikationer.
För över en tredjedel av indikationerna som godkänts på dessa grunder hittades inga kliniska studier efter godkännandet. För mindre än 10 procent av de godkända indikationerna fanns det en eller flera publicerade randomiserade dubbelblindade studier som visade positiv effekt av läkemedlet, baserat på kliniskt relevant utfall och inte surrogatmarkörer, i mediantid 5,5 år efter godkännandet.
Elin Jerremalm
- EMA. Conditional marketing authorization – Report on ten years of experience at the European Medicines Agency
- Banzi R, Gerardi C, Bertele' V, Garattini S. Conditional approval of medicines by the EMA. BMJ. 2017 May 2;357:j2062. PubMed
- Pease AM, Krumholz HM, Downing NS, Aminawung JA, Shah ND, Ross JS. Postapproval studies of drugs initially approved by the FDA on the basis of limited evidence: systematic review. BMJ. 2017 May 3;357:j1680. PubMed
Observera: nyhetstexterna är aktuella när de publiceras och uppdateras normalt inte.
Senast ändrad
